
实时更新中芯汇金最新动态,了解中芯汇金
发布时间 :2022-11-16 11:11:34

单克隆抗体(mAbs)作为治疗手段的潜力是毋庸置疑的。目前,mAbs市场的规模预计在1500亿美元左右。2021年,前10大畅销药物中有5种是mAbs,预计未来五年这一趋势将保持不变。自然,制药行业看到了mAbs的爆发,这推动了新方法的发展,以改善和完善抗体管线。
人工智能(AI)和深度学习已经改变了小分子药物设计的多个方面。该领域的最新进展现在也影响到更复杂的任务,如抗体的设计和优化。
因此,2022年出现了突破,以色列Biolojic design创造的首个计算设计抗体进入临床试验,进一步激发了生物制药公司的兴趣。

传统上,mAbs最初是通过实验技术发现的(hit identification, HI),如杂交瘤细胞筛选、酵母或噬菌体展示的高通量平台。这个过程之后,是计算引导的突变或抗体序列的进化(hit to lead, or H2L, optimisation),以改善结合和其他特性。
尽管该领域还处于初级阶段,但几家AI公司在过去几年里取得了有意义的进展。现在,行业有足够的案例研究来证明AI引导的HIT进化对改善结合、溶解度、产量和免疫原性等方面的好处。
因此,先导优化或分子进化产品在初创企业中相对更常见。然而,也有少数公司正在从靶点/抗原着手进行候选基因的从头设计,而不需要耗时和昂贵的实验方法,这可能会改变游戏规则。
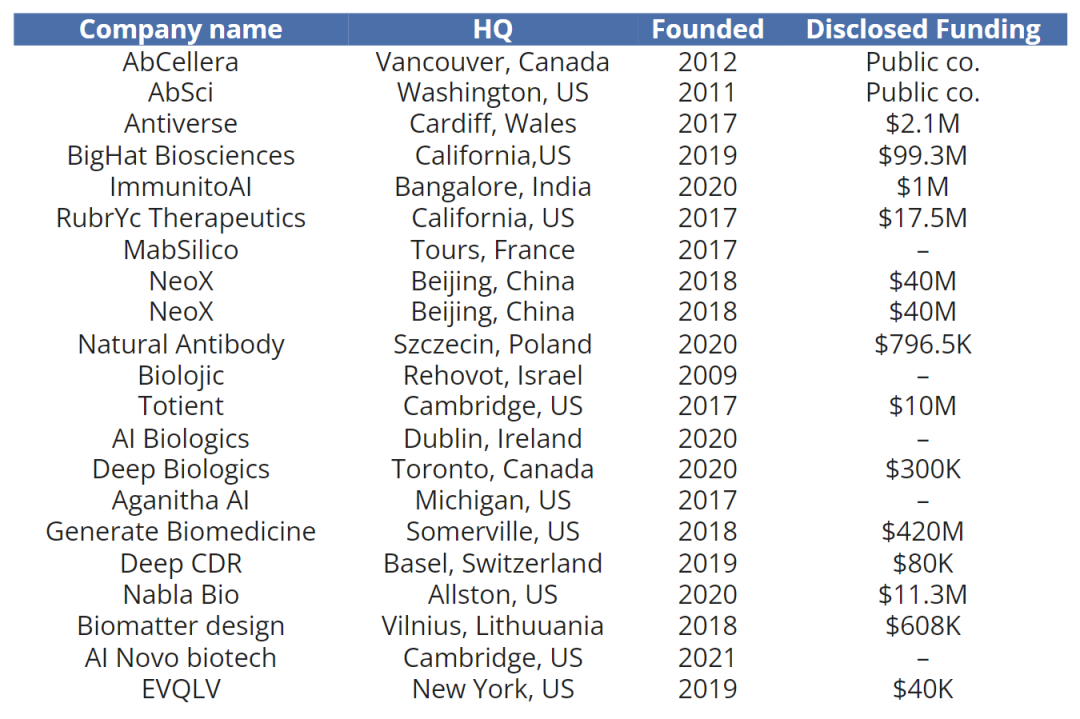
公司间如何以不同方式使用AI加速抗体发现,这值得行业关注。比较有代表性的包括以下几家:
该公司成立于2018年,总部位于波士顿,目前已融资4.2亿美元。Generate Bio结合了基于序列和结构的方法,对各种蛋白质进行从头设计,包括具有所需特性的抗体。除了专有的生成式AI,该公司还有自己的自动化平台,可以在迭代中快速合成和测试抗体。
这家总部位于加利福尼亚的公司成立于2019年,到目前为止筹集了约1亿美元。他们开发了一个综合平台,结合了使用无细胞系统的高通量合成和抗体优化AI平台(antibody optimisation AI platform)建议的抗体测试。
BigHat采用基于序列的方法,这需要通过其他途径发现的HIT数据或抗体的初始序列。然后,将初始抗体序列借助机器学习(ML)模型进行优化,如与靶点的结合、溶解度、免疫原性和产量等。在每个测试周期中生成的数据用于更新AI/ML模型,以进行下一个迭代周期。
BigHat于2022年收购Frugi Biotechnology,后者是一家开发高成本和高质量无细胞蛋白合成(CFPS)技术的公司。他们有五个内部管线和合作项目。
这家成立于2009年的以色列公司,采用基于结构的方法,他们的模型在数百万抗体-抗原对上进行训练,以便从现有的人类抗体中识别针对所需目标的模板抗体。然后,它使用不同的ML模型来预测突变,并指导识别模板抗体的优化,以提高亲和力和其他生物物理特性。
尽管上述三家公司都是最具发展潜力的公司,但该领域仍在快速发展。目前,AI抗体领域已经出现一长串的Biotech名单。

观察到这些平台的潜力,Biopharma已经开始探索与少数公司的合作,并建立内部能力。例如,今年1月,安进选择和Generate Bio携手,针对5个靶点研究开发蛋白质疗法。
根据该协议,安进将向Generate Bio支付5000万美元的预付款,合作潜在总金额将超过19亿美元。更早前的2021年7月,安进以9亿美元的价格收购Teneobio,进一步增强抗体技术。现阶段来看,安进旨在将积累的基础和Generate Bio的AI平台深度结合,实现更高效的抗体药物开发。
2020年,Chugai(中外制药)宣布数字化战略CHUGAI DIGITAL VISION 2030,目标是利用数字技术,提高成功发现药物的可能性。此前,Chugai的发明的抗体相关技术平台,几乎涵盖抗体的各方面。2021年3月,Chugai发布了其内部AI平台MALEXA-LI的抗体发现结果。
值得注意的还有基因泰克。2021年8月,基因泰克对AI抗体赛道展露出强烈兴趣,收购了Prescient Design。这家公司拥有深度学习蛋白质设计平台和广泛的专业知识,可帮助识别和设计抗体,最终目标是在计算机上快速设计候选治疗药物。
阿斯利康、辉瑞、默沙东、梯瓦四家药企则尝试建立更广泛的联盟。2021年10月,他们与亚马逊、以色列生物技术基金(IBF)合作,推出AION Labs作为加速AI驱动抗体发现的孵化器。AION Labs将为早期创业团队提供资金和技术支持。
从数十亿个潜在抗体序列中选择候选药物可能需要数年时间,费用昂贵,并且在许多情况下无法识别功能性抗体。按照设想,AION Labs将在全球范围内,寻找治疗性抗体全新计算设计相关的生物医学科学家和发明家。

与小分子AI药物研发生态系统相比,AI抗体领域的发展方式有所不同。
AI在抗体药物领域的应用是远远落后于小分子领域的。一方面,抗体的结构与功能的对应关系复杂,另一方面,抗体数据获取困难导致缺乏。
因此,那些“闭环”公司将高通量试验与AI技术相结合,将优于计算机平台本身。通过学习小分子AI领域的发展,大多数抗体公司也开始专注于内部管线,这些资产可以提供的显著优势,而不是单纯的服务模式。
考虑到为抗体等复杂分子建立AI模型的复杂性,参与者的数量很可能明显少于小分子AI领域。故而数据集的有限可用性,使这些“闭环”公司更有吸引力,因为他们不断生成自己的数据来改善预测。
最近的里程碑,包括AI公司和制药公司之间的几项大型交易,通过并购退出机会,吸引投资者进一步探索该领域的潜在投资机会。不过,AI抗体发现领域距离达到AI小分子发现领域的成熟水平,还有三四年的时间。
尽管如此,对于生物制药来说,这是激动人心的时刻,这些AI平台正在影响现状并改变我们发现药物的方式。随着ML算法的突破、计算能力的增长,测序技术和生物合成技术的普及,ML算法开始拥有前所未有的生物学数据规模。
2022年7月,DeepMind对外称,其通过AlphaFold 2成功预测了来自100万个物种的约2亿种蛋白质结构,几乎涵盖地球上所有已知的蛋白质。合作方欧洲生物信息研究所(EMBL-EBI)确认,这些蛋白结构中35%是高度准确的(达到了实验室测定的结构精度),80%的可靠性足以用于多项后续的研究和分析。
可以预期,AI技术应用于抗体领域已经成势。无论是发现新抗原、抗体,还是优化抗体、从头生成抗体/蛋白质,AI的应用将为生物制药打开新的空间。