
实时更新中芯汇金最新动态,了解中芯汇金
发布时间 :2023-04-06 10:22:27

纯化的 Photorhabdus virulence cassettes(PVCs),透射电子显微镜成像
物质的跨膜运输是生命活动中不可或缺的一环,却也是许多疾病发生和发展的罪魁祸首。如何将物质安全、高效、特异地输送到目标细胞,一直是生物技术研究的难点。虽然有病毒 载体、纳米粒子、外泌体等多种方法,但它们都存在一定的局限性,如安全性、效率、特异 性、可控性等。因此,开发一种既针对特定细胞类型,又能够跨膜输送选择性蛋白质的工具,成为了一项艰巨的任务。
近日,Nature杂志在线发表了一篇来自美国麻省理工学院(MIT)和哈佛大学(Harvard) 的合作研究论文,题目为“Programmable protein delivery with a bacterial contractile injection system”。该篇论文主要解决了一项跨膜运输相关的难题:如何利用细菌的收缩 注射系统来进行可编程的蛋白质输送。
简而言之:
1. 研究人员利用一种自然的细菌系统,开发了一种新的蛋白质递送方法,可在人类和动 物细胞中发挥作用。
2. 这项技术可以编程递送各种蛋白质(包括用于基因编辑的蛋白质),递送到不同的细 胞类型中。
3. 这个系统有可能成为递送基因治疗和癌症治疗药物的一种安全高效的方法。
自然界中,内共生细菌是一类与宿主共生的微生物,它们就像一群“护士”,演化出一 套高效的“输送系统”--细菌与宿主的生物学接口。共生菌使用类似于注射器的纳米级结构, 向宿主细胞注射蛋白质,以调节周围的生物学环境并增强其生存能力。这种外形像细菌鞭毛 的结构,被称为胞外收缩注射系统(eCISs),由一个套在里面的硬管和一个能收缩的鞘组成。当它遇到目标细胞时,像一个针头一样的鞭子顶端会穿透细胞膜,随后迫使管内的载荷物质 直接注入到细胞内部,如同一个细胞用的超级小型注射器。
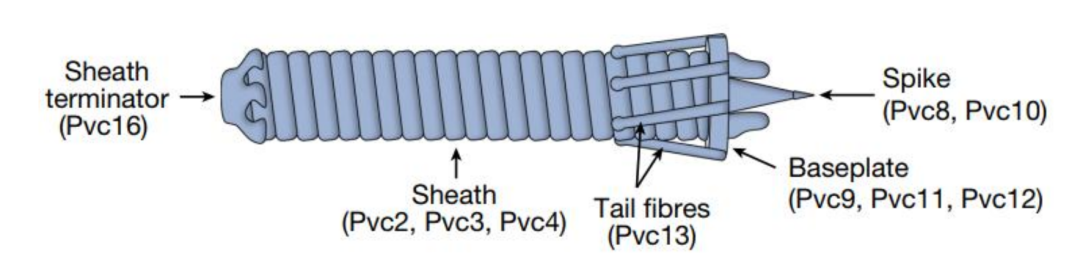
胞外收缩注射系统(eCISs)模式图
而在eCISs顶端的外侧,存在另外一种重要结构--尾纤维,可以识别并锁定细胞表面上特定受体。先前的研究发现,eCISs可以自然地靶向昆虫和小鼠细胞,这意味着这些系统可能具有输送治疗性蛋白质的潜能。但是,目前还不清楚eCISs是否能够在人类细胞中发挥作用,也不清楚这些系统锁定靶细胞的机制。

PVCs(绿色)在注射有效载荷蛋白之前与昆虫细胞(蓝色)结合
该团队表示,尽管目前缺乏足够的证据表明eCISs可以在人类中发挥天然功能,但这项技术仍可能为治疗癌症和其他疾病提供一种全新的方法,尤其是那些需要基因治疗的疾病。因此,研究人员并没有局限于寻找天然可识别人细胞的蛋白质收缩注射系统,而是提出了一种大胆而富有创意的想法:通过重新设计尾纤维并结合不同的受体,将其改造为适用于人类细胞的蛋白质输送系统。这种利用蛋白质工程来改变自然系统的生物活性的尝试,无疑是 一次令人振奋且有趣的探索。
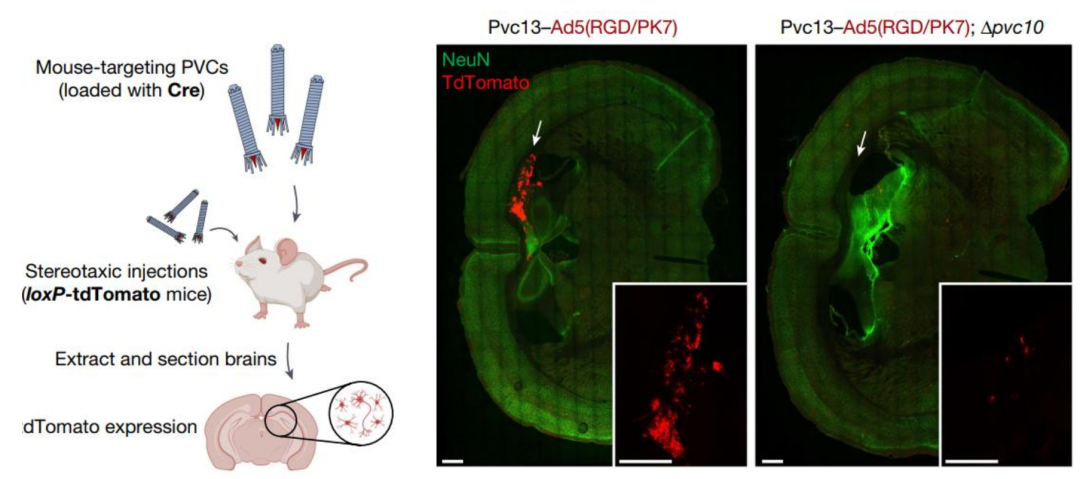
eCISs通过尾纤蛋白的远端结合元件对靶受体进行特异性识别,从而实现了对特定类型细胞的靶向选择和有效的蛋白质载荷注射。研究人员利用人工智能工具AlphaFold重新设计了Photorhabdus菌产生的eCISs的尾纤维,使其能够结合人类细胞,并创建了一种基于这种寄生性细菌胞外注射系统的可编程注射器——Photorhabdus virulence cassettes (PVCs)。这种装置包含一个空心针,可携带荷物并刺穿目标细胞。针通过收缩机制物理强迫 穿过靶向细胞膜并伸入细胞内部。
通过对尾纤维使用体外结构引导工程的方法,研究人员能够重新编程 PVCs,使其能够靶向系统原本不靶向的生物,包括人类和小鼠,而且在特定条件下效率接近100%。这意味着,通过重新设计尾纤维,研究人员可以改变这种系统的靶向细胞类型,从而为治疗癌症和其他疾病提供了一种新的方法。这项创新研究让人们看到了蛋白质工程的巨大潜力,同时也为开发更有效的药物输送系统打开了新的大门。
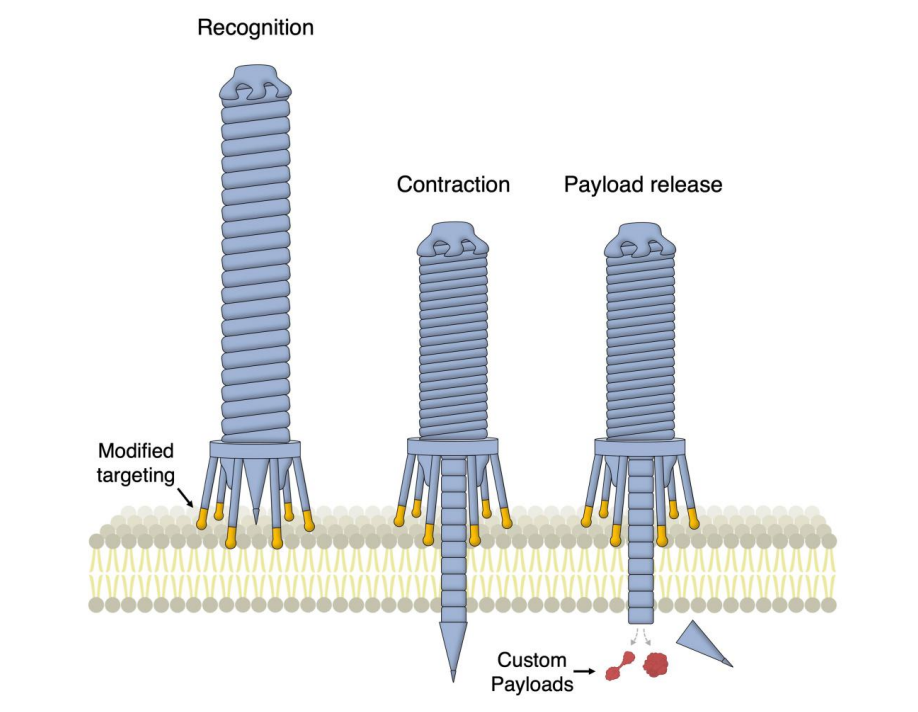
通过重新编程PVCs进行蛋白质输送的模式图
科学家们通过重新设计蛋白质复合物的一部分结构,成功地改进了注射器的输送能力。他们制造了一种针对表达 EGF 受体的癌细胞的 eCISs,结果表明这种注射器能够几乎 100% 地杀死含有 EGF受体的癌细胞,而对没有该受体的细胞则没有影响。虽然注射器的效率在一定程度上取决于所靶向的受体,但这些发现证明了通过精密的重新编程,该系统将具有巨大 的肿瘤精准治疗潜力。这个创新性的设计为肿瘤治疗提供了一种更加准确和有效的方法。
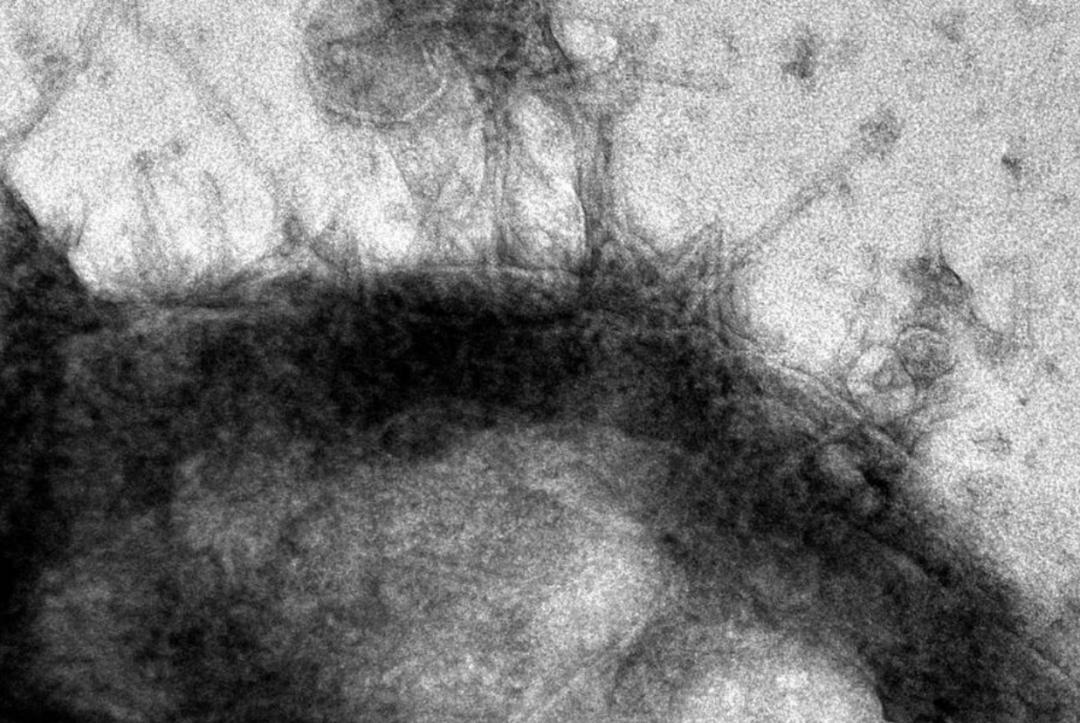
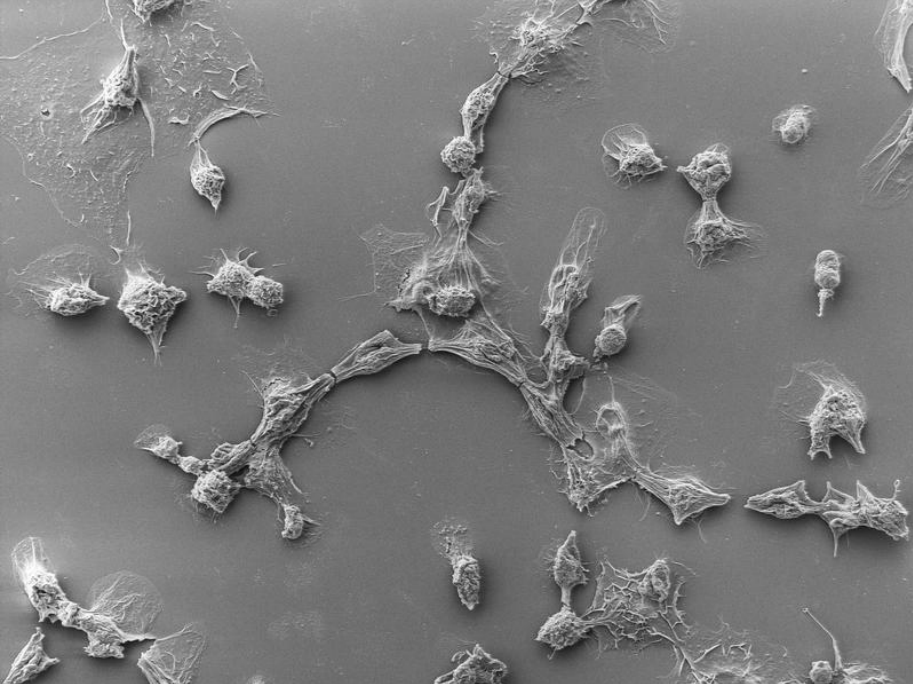
结论